Na2SO4 kết tủa color gì
Na2SO4 với kết tủa không? nội dung tư liệu được VnDoc biên soạn ngoài các việc canh ty chúng ta học viên trả lời vướng mắc liệu Na2SO4 có kết tủa ko tư liệu còn nhắm tới cụ thể mò mẫm hiểu về muối hạt Sodium Sulphate, về đặc thù của Na2SO4, công thức kết cấu Na2SO4 như vậy nào?
1. Na2SO4 là hóa học gì?
Sodium Sulphate là một trong những phù hợp hóa học muối hạt dung hòa của natri được tạo nên trở nên tự Sulfuric acid.
Công thức chất hóa học của Sodium Sulphate Na2SO4.
Sodium Sulphate tồn bên trên ở dạng khan được đặc thù tự tinh nghịch thể white color và ngoại giả còn tồn bên trên bên dưới dạng ngậm nước là Na2SO4.10H2O
Công thức kết cấu của Na2SO4
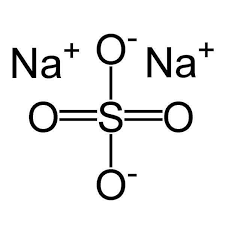
2. Tính hóa học của Na2SO4
Na2SO4 với white color, ko hương thơm và với vị đắng
Sodium sulphate hoàn toàn có thể phản xạ với sulfuric acid tạo nên muối hạt Sodium Bisulfate:
Na2SO4 + H2SO4 ⇌ 2NaHSO4
Na2SO4 với đặc thù trao thay đổi ion
Cách đưa đến những sulfate ko tan khi xử lý những hỗn hợp này với muối hạt Ba2+ hoặc Pb2+:
Na2SO4 + BaCl2 → 2NaCl + BaSO4 (Kết tủa)
3. Na2SO4 với kết tủa không?
Không nên hóa học kết tủa
Phản ứng Na2SO4 với những muối hạt BaCl2, Ba(NO3)2, hoặc base Ba(OH)2 sẽ tạo nên rời khỏi kết tủa White của BaSO4
Na2SO4 + Ba(NO3)2 → NaNO3 + BaSO4 ↓ trắng
4. Điều chế muối hạt Sodium sulphate
- Na2SO4 được chống thực nghiệm điều chế
Na2SO4 được tổ hợp kể từ phản xạ thân thiện sodium bicarbonate và magnesium sulfate.
2NaHCO3 + MgSO4 → Na2SO4 + Mg(OH)2 + 2CO2
- Điều chế nhập công nghiệp như sau
2NaCl + H2SO4 → 2HCl + Na2SO4
Na2SO4 tồn bên trên ở dạng được 2NaOH + H2SO4 → Na2SO4 + 2H2O
5. Các hóa học kết tủa thông thường gặp gỡ và sắc tố của chúng
STT | Chất kết tủa | Màu sắc kết tủa | STT | Chất kết tủa | Màu sắc kết tủa |
1 | Al(OH)3 | Keo trắng | 15 | CaCO3 | Trắng |
2 | FeS | Màu đen | 16 | AgCl | Trắng |
3 | Fe(OH)2 | Trắng xanh | 17 | AgBr | Vàng nhạt |
4 | Fe(OH)3 | Màu đỏ | 18 | AgI | Màu vàng cam hoặc vàng đậm |
5 | FeCl2 | Dung dịch color lục nhạt | 19 | Ag3PO4 | Màu vàng |
6 | FeCl3 | Dung dịch gold color nâu | 20 | Ag2SO4 | Trắng |
7 | Cu | Màu đỏ | 21 | MgCO3 | Kết tủa trắng |
8 | Cu(NO3)2 | Dung dịch xanh lơ lam | 22 | CuS, FeS, Ag2S, PbS, HgS | Màu đen |
9 | CuCl2 | Tinh thể gray clolor, hỗn hợp blue color lá cây | 23 | BaSO4 | Trắng |
10 | Fe3O4 (rắn) | Màu nâu đen | 24 | BaCO3 | Trắng |
11 | CuSO4 | Tinh thể khan với white color, tinh nghịch thể ngậm nước và hỗn hợp blue color lam | 25 | Mg(OH)2 | Trắng |
12 | Cu2O | Có red color gạch | 26 | PbI2 | Vàng tươi |
13 | Cu(OH)2 | Màu xanh rì (xanh domain authority trời) | 27 | C6H2Br3OH | Trắng ngà |
14 | CuO | Màu đen | 28 | Zn(OH)2 | Keo trắng |
5. Câu căn vặn áp dụng liên quan
Câu 1. Thuốc demo nào là tại đây dùng làm phân biệt khí H2S với khí CO2?
A. hỗn hợp HCl
B. hỗn hợp Pb(NO3)2
C. hỗn hợp Na2SO4
D. hỗn hợp NaCl
Xem đáp án
Đáp án B
Thuốc demo dùng làm phân biệt khí H2S với khí CO2 là hỗn hợp Pb(NO3)2 vì thế CO2 ko tạo nên kết tủa với Pb(NO3)2
Câu 2. Trường phù hợp nào là tại đây ko xẩy ra phản xạ hóa học?
A. 3O2 + 2H2S → 2H2O + 2SO2
B. FeCl2 + H2S → FeS + 2HCl
C. SO2 + 2H2S → 3S + 2H2O
D. SO3 + 2NaOH → Na2SO4 + H2O
Xem đáp án
Đáp án B
Trường phù hợp ko xẩy ra phản xạ chất hóa học là:
B. FeCl2 + H2S → FeS + 2HCl
Vì FeS tan nhập acid
Câu 3. Dãy hóa học nào là trong số mặt hàng tại đây bao gồm những hóa học đều thể hiện nay tính lão hóa khi phản xạ với SO2?
A. H2S, O2, nước bromine
B. O2, nước brom, hỗn hợp KMnO4
C. Dung dịch NaOH, O2, hỗn hợp KMnO4
D. Dung dịch BaCl2, CaO, nước bromine
Xem đáp án
Đáp án A
A. O2, nước bromine, hỗn hợp KMnO4.
Đúng vì thế SO2 là hóa học khử ( với số OXH tăng kể từ +4 lên +6)
B. Dung dịch NaOH, O2, hỗn hợp KMnO4.
Sai.Vì NaOH ko thể tính tính oxh hoặc khử khi thuộc tính với SO2
C. Dung dịch Ba(OH)2, H2S, nước bromine.
Sai. Vì với Ba(OH)2
D. H2S, O2, nước brom.
Câu 4. Cho những đánh giá sau:
(a) Sự năng lượng điện li của hóa học năng lượng điện li yếu ớt là thuận nghịch tặc.
(b) Chỉ với phù hợp hóa học ion mới nhất hoàn toàn có thể năng lượng điện li được nội địa.
(c) Chất năng lượng điện li phân li trở nên ion khi tan nhập nước hoặc bên trên tình trạng rét chảy.
(d) Nước là dung môi phân vô cùng, với tầm quan trọng cần thiết nhập quy trình năng lượng điện li.
(e) Chất năng lượng điện li mạnh là hóa học khi tan nội địa, những phân tử hòa tan đều phân li rời khỏi những hóa học.
Số đánh giá đích thị là:
A. 1
B. 2
C. 3
D. 4
Xem đáp án
Đáp án C
(a) Sự năng lượng điện li của hóa học năng lượng điện li yếu ớt là thuận nghịch tặc.
(c) Chất năng lượng điện li phân li trở nên ion khi tan nhập nước hoặc bên trên tình trạng rét chảy.
(d) Nước là dung môi phân vô cùng, với tầm quan trọng cần thiết nhập quy trình năng lượng điện li.
Câu 5. Dãy hóa học nào là tại đây bao gồm toàn muối hạt ko tan nhập nước
A. Na2SO3, Al2(SO4)3, KHSO4, Na2S
B. KCl, Ba(NO3)2, CuCl2, Ca(HCO3)2
C. ZnCl2, Mg(NO3)2, KCl, K2S
D. BaSO4, AgCl, CaCO3, Ca3(PO4)2
Xem đáp án
Đáp án D
BaSO4, AgCl, CaCO3, Ca3(PO4)2 đều là những kết tủa ko tan được nội địa.
......................................
