Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O là phản xạ lão hóa khử. Bài viết lách này hỗ trợ rất đầy đủ vấn đề về phương trình chất hóa học và đã được thăng bằng, ĐK những hóa học nhập cuộc phản xạ, hiện tượng lạ (nếu có), ... Mời chúng ta đón xem:
Phản ứng Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
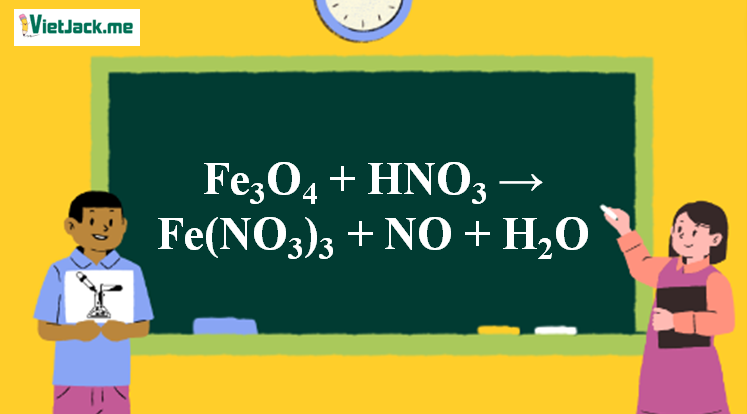
1. Phương trình phản xạ Fe3O4 tính năng HNO3
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑ + 14H2O
2. Điều khiếu nại phản xạ Fe3O4 tính năng với hỗn hợp HNO3
Điều kiện: Không có
3. Cân vì như thế phương trình lão hóa khử Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
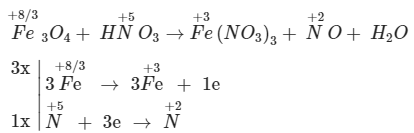
Cân bằng: 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
4. Cách tổ chức phản xạ cho tới Fe3O4 tính năng với hỗn hợp HNO3
Cho Fe3O4 tính năng với hỗn hợp axit nitric HNO3.
5. Hiện tượng hóa học
Hiện tượng sau phản xạ bay đi ra khí ko màu sắc NO hóa nâu vô không gian.
6. Bản hóa học của những hóa học nhập cuộc phản ứng
6.1. Bản hóa học của Fe3O4 (Sắt kể từ oxit)
- Trong phản xạ bên trên Fe3O4 là hóa học khử.
- Oxit Fe kể từ sở hữu tính khử thể hiện tại Khi tính năng với những hóa học sở hữu tính oxi hoá mạnh như: HNO3, H2SO4 quánh...
6.2. Bản hóa học của HNO3 (Axit nitric)
- Trong phản xạ bên trên HNO3 là hóa học oxi hoá.
- HNO3 tác dụng với oxit bazo, bazo, muối bột tuy nhiên sắt kẽm kim loại vô phù hợp hóa học ko lên hoá trị tối đa.
7. Tính hóa học của Fe kể từ oxit Fe3O4
7.1. Định nghĩa
Là lếu láo phù hợp của nhị oxit FeO, Fe2O3. Có nhiều vô quặng manhetit, sở hữu kể từ tính.
Công thức phân tử Fe3O4
7.2. Tính hóa học vật lí oxit Fe từ
Là hóa học rắn, black color, ko tan nội địa và sở hữu kể từ tính.
7.3. Tính Hóa chất oxit Fe từ
+ Tính oxit bazơ
Fe3O4 tính năng với hỗn hợp axit như HCl, H2SO4 loãng dẫn đến lếu láo phù hợp muối bột Fe (II) và Fe (III).
Fe3O4 + 8HCl → 2FeCl3+ FeCl2 + 4H2O
Fe3O4 + 4H2SO4 loãng→ Fe2(SO4)3+ FeSO4 + 4H2O
+ Tính khử
Fe3O4 là hóa học khử Khi tính năng với những hóa học sở hữu tính lão hóa mạnh:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3+ NO + 14H2O
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2↑ + 10H2O
+ Tính oxi hóa
Fe3O4 là hóa học lão hóa Khi tính năng với những hóa học khử mạnh ở sức nóng chừng cao như: H2, CO, Al:
Fe3O4 + 4H2 → 3Fe + 4H2O
Fe3O4+ 4CO → 3Fe + 4CO2
3 Fe3O4 + 8Al → 4Al2O3 + 9Fe
7.4. Ứng dụng
- Quặng manhetit sở hữu dung lượng Fe tối đa được sử dụng vô ngành luyện gang, thép.
- Fe3O4 phân tử nano được dùng làm dánh lốt tế bào và xử lí nước bị nhiểm không sạch.
8. Tính Hóa chất của HNO3
- Axit nitric là 1 trong những hỗn hợp nitrat hydro sở hữu công thức chất hóa học HNO3 . Đây là 1 trong những axit khan, là 1 trong những monoaxit mạnh, sở hữu tính lão hóa mạnh rất có thể nitrat hóa nhiều phù hợp hóa học vô sinh, sở hữu hằng số thăng bằng axit (pKa) = −2.
- Axit nitric là 1 trong những monoproton chỉ tồn tại một sự phân ly nên vô hỗn hợp, nó bị năng lượng điện ly trọn vẹn trở thành những ion nitrat NO3− và một proton hydrat, hoặc thường hay gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric sở hữu đặc điểm của một axit thông thường nên nó thực hiện quỳ tím gửi thanh lịch red color.
- Tác dụng với bazo, oxit bazo, muối bột cacbonat tạo ra trở thành những muối bột nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tính năng với kim loại: Tác dụng với đa số những sắt kẽm kim loại trừ Au và Pt tạo ra trở thành muối bột nitrat và nước .
Kim loại + HNO3 đặc → muối bột nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối bột nitrat + NO + H2O
Kim loại + HNO3 loãng rét mướt → muối bột nitrat + H2
Mg(rắn) + 2HNO3 loãng rét mướt → Mg(NO3)2 + H2 (khí)
- Nhôm, Fe, crom thụ động với axit nitric quánh nguội vì thế lớp oxit sắt kẽm kim loại được dẫn đến bảo đảm bọn chúng không biến thành lão hóa tiếp.
- Tác dụng với phi kim (các nhân tố á kim, nước ngoài trừ silic và halogen) tạo ra trở thành nito dioxit trong trường hợp là axit nitric quánh và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P.. + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối bột tuy nhiên sắt kẽm kim loại vô phù hợp hóa học này ko lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với phù hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan vô HNO3, HgS ko tính năng với HNO3.
- Tác dụng với khá nhiều phù hợp hóa học hữu cơ: Axit nitric sở hữu năng lực đập bỏ nhiều phù hợp hóa học cơ học, nên tiếp tục cực kỳ nguy khốn nếu như nhằm axit này xúc tiếp với khung hình người.
9. Bài tập luyện áp dụng liên quan
Câu 1. Fe3O4 rất có thể tính năng được với những hóa học vô mặt hàng nào là sau đây?
A. CO, H2SO4
B. HNO3, KCl
C. H2, NaOH
D. HCl, MgCl2
Lời giải:
Đáp án: A
Phương trình hóa học:
Fe3O4 + 4CO → 3Fe + 4CO2
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
B sai vì như thế Fe3O4 ko phản xạ với KCl
C sai vì như thế Fe3O4 ko phản xạ với NaOH
D sai vì như thế Fe3O4 ko phản xạ với MgCl2
Câu 2. Cho những hóa học sau: Fe(OH)3, Fe3O4, FeSO4, Fe(NO3)2. Số hóa học tính năng với hỗn hợp HCl là
A. 4.
B. 2.
C. 3.
D. 1.
Lời giải:
Đáp án: C
Các hóa học tính năng được với hỗn hợp HCl là: Fe(OH)3, Fe3O4, Fe(NO3)2 → sở hữu 3 chất
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
9Fe(NO3)2 + 12HCl → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
Câu 3. Hòa tan trọn vẹn 6,96 gam Fe3O4 vô hỗn hợp HNO3 loãng sau phản xạ chiếm được khí ko màu sắc hóa nâu vô không gian (sản phẩm khử duy nhất). Tính thể tích khí chiếm được ở đktc là:
A. 224 ml
B. 448 ml
C. 336 ml
D. 896 ml
Lời giải:
Đáp án: A
Theo đề bài bác tớ có:
nFe3O4 = 0,03 mol;
Phương trình hóa học:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑+ 14H2O
=> nNO = = 0,01
=> VNO= 0,01.22,4 = 0,224 lít = 224 ml
Câu 4. Chất nào là sau đây ko phản xạ với HNO3 quánh nguội
A. Zn
B. Cu
C. Fe
D. Ag
Lời giải:
Câu 5. Dùng hóa hóa học nào là tại đây nhằm nhận ra 3 hỗn hợp mất mặt nhãn sau: HNO3, H2SO4, H2O
A.quỳ tím và hỗn hợp BaCl2
B. quỳ tím và hỗn hợp NaOH
C. hỗn hợp NaOH
D. Na và hỗn hợp quỳ tím
Lời giải:
Đáp án: A
Trích kiểu demo và viết số loại tự
Sử dụng quỳ tím nhận ra được HNO3, H2SO4
Không thực hiện thay đổi màu sắc quỳ tím là H2O
Dùng BaCl2 nhằm nhận ra 2 hỗn hợp còn lại
Ống nghiệm xuất hiện tại kết tủa White thì hỗn hợp ban sơ là H2SO4
BaCl2 + H2SO4 → BaSO4 + HCl
Không sở hữu hiện tượng lạ gì là HNO3
Câu 6. Dung dịch Fe2+ ko làm mất đi màu sắc hỗn hợp nào là sau đây?
A. Dung dịch KMnO4 vô môi trường xung quanh H2SO4
B. Dung dịch K2Cr2O7 vô môi trường xung quanh H2SO4
C. Dung dịch Br2
D. Dung dịch CuCl2
Lời giải:
Đáp án: D
Mất màu sắc dung dịch tím
10FeCl2 + 24H2SO4+ 6KMnO4 → 10Cl2 + 5Fe2(SO4)3 + 24H2O + 6MnSO4 + 3K2SO4
Mất màu sắc hỗn hợp màu sắc domain authority cam
6FeCl2 + K2Cr2O7 + 14HCl → 6FeCl3 + 2KCl + 2CrCl3 + 7H2O
Mất gray clolor đỏ
6FeCl2 + 3Br2 → 4FeCl3 + 2FeBr3
Câu 7. Cho lếu láo phù hợp bột Al, Fe vô hỗn hợp chứa chấp Cu(NO3)2 và AgNO3. Sau Khi những phản xạ xẩy ra trọn vẹn, chiếm được lếu láo phù hợp rắn bao gồm thân phụ sắt kẽm kim loại là:
A. Al, Cu, Ag.
B. Al, Fe, Cu.
C. Fe, Cu, Ag.
D. Al, Fe, Ag
Lời giải:
Đáp án: C
Nhận thấy, nếu như Al dư thì chắc chắn rằng Fe ko phản xạ , và cả Cu2+ và Ag+ đều bị đẩy thoát ra khỏi muối bột (tạo Ag , Cu)
2Al + 3Cu(NO3)2→ 2Al(NO3)3 + 3Cu
Al + 3AgNO3 → Al(NO3)3 + 3Ag
=> Nêu Al dư sở hữu toàn bộ 4 Kim loại sau phản xạ (trái fake thiết)
=> Do cơ Al không còn => 3 sắt kẽm kim loại là Fe, Cu , Ag
Câu 8. Trộn 5,4 gam bột Al với 17,4 gam bột Fe3O4 rồi tổ chức phản xạ sức nóng nhôm vô ĐK không tồn tại không gian. Giả sử chỉ xẩy ra phản xạ khử Fe3O4 trở thành Fe. Hoà tan trọn vẹn lếu láo phù hợp rắn sau phản xạ vì như thế hỗn hợp H2SO4 loãng (dư), chiếm được 5,376 lít khí H2 (đktc). Hiệu suất của phản xạ sức nóng nhôm là
A. 80%.
B. 90%.
C. 70%.
D. 60%.
Lời giải:
Đáp án: A
nAl= 0,2 mol;
nFe3O4 = 0,075 mol
Gọi x là số mol Al phản xạ.
8Al + 3Fe3O4 → 9Fe + 4Al2O3
x →
=> nAl dư =0,4 - x
nFe =
Al + 3HCl → AlCl3 + H2
Fe + 2HCl → FeCl2+ H2
=> nH2 = + = 0,24
=> x = 0,16
=> H = = 80%
Câu 9. Hòa tan trọn vẹn 25,6 gam lếu láo phù hợp A bao gồm Cu và Fe2O3 vô hỗn hợp HNO3 2M (dư 20% đối với lượng cần thiết phản ứng) chiếm được hỗn hợp B và 2,24 lít NO (đktc) là thành phầm khử độc nhất. Thành phần xác suất lượng Fe2O3 vô hỗn hợp A là:
A. 62,5%
B. 37.5%
C. 40%
D. 60%.
Lời giải:
Đáp án: A
Phương trình phản ứng
(1) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
(2) Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
nNO= = 0,1 mol
Áp dụng quyết định luật bảo toàn electron tớ có:
2nCu = 3nNO => nCu = 1,5nNO = 1,5.0,1 = 0,15 mol
=> mFe2O3 = mhỗn hợp – mCu = 25,6 – 0,15.64 = 16 gam
=> nFe2O3 = = 0,1 mol
=> %mFe2O3 = ().100% = 62,5%
Câu 10. Cho bột Fe vô hỗn hợp AgNO3 dư, sau khoản thời gian kết giục thí nghiệm thu sát hoạch được hỗn hợp X gồm:
A. Fe(NO3)2, H2O
B. Fe(NO3)2, AgNO3
C. Fe(NO3)3, AgNO3
D. Fe(NO3)2, Fe(NO3)3, AgNO3
Lời giải:
Đáp án: C
Phương trình phản xạ hóa học
2AgNO3 + Fe → 2Ag + Fe(NO3)2
AgNO3 + Fe(NO3)2→ Ag + Fe(NO3)3
Câu 11. Nhận quyết định trúng về phản xạ pha chế HNO3 vô chống thử nghiệm vì như thế phản ứng
NaNO3 + H2SO4 → HNO3 + NaHSO4.
A. rất có thể sử dụng axit sunfuric loãng.
B. rất có thể thay cho thế natri nitrat vì như thế kali nitrat.
C. axit nitric chiếm được ở dạng lỏng ko cần thiết thực hiện rét mướt.
D. đấy là phản xạ lão hóa khử.
Lời giải:
Đáp án: B
A sai vì như thế ko thể sử dụng axit sunfuric loãng.
B trúng vì như thế rất có thể thay cho thế natri nitrat vì như thế kali nitrat.
C sai vì như thế axit nitric dễ dàng cất cánh khá nên chiếm được khá HNO3.
D sai vì như thế đấy là phản xạ trao thay đổi vì như thế ko thực hiện thay cho thay đổi số lão hóa.
Câu 12. Nhiệt phân trọn vẹn m gam lếu láo phù hợp Al(NO3)3 và Fe(NO3)2 chiếm được 47,3 gam hóa học rắn Y. Hòa tan Y vô hỗn hợp NaOH thấy sở hữu 0,3 mol NaOH phản xạ. Khối lượng lếu láo phù hợp muối bột là
A. 88,8.
B. 135,9.
C. 139,2.
D. 69,6.
Lời giải:
Đáp án: B
Xác quyết định bộ phận hóa học Y
2Fe(NO3)2→ Fe2O3 + 4NO2 + 0,5O2
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
⟹ Chất rắn Y bao gồm Fe2O3 và Al2O3
Tính nFe2O3và nAl2O3
Khi cho tới Y vô NaOH thì chỉ mất Al2O3 phản ứng
2NaOH + Al2O3 → 2NaAlO2 + H2O.
0,3 → 0,15
⟹ mAl2O3 = 102.0,15 = 15,3 gam
⟹ mFe2O3 = mchất rắn - mAl2O3 = 47,3 - 15,3 = 32 gam
⟹ nFe2O3= 0,2 mol
Tính m gam hh Al(NO3)3 và Fe(NO3)2
Bảo toàn nhân tố Fe ⟹ nFe(NO3)2 = 2nFe2O3 = 0,4 mol ⟹ mFe(NO3)2 = 72 gam
Bảo toàn nhân tố Al ⟹ nAl(NO3)3 = 2nAl2O3 = 0,3 mol ⟹ mAl(NO3)3 = 63,9 gam
⟹ m = mFe(NO3)2 + mAl(NO3)3= 135,9 gam.
Câu 13. Cho Na2O vô hỗn hợp muối bột X, chiếm được kết tủa white color. Muối X là hóa học nào là sau đây?
A. NaCl.
B. FeCl3.
C. CuCl2.
D. MgCl2.
Lời giải:
Đáp án: D
Khi cho tới Na2O vô nước sở hữu phản xạ sau: Na2O + H2O → NaOH
A. NaCl ko phản xạ với NaOH
B. FeCl3 tính năng với NaOH sinh tớ kết tủa gray clolor đỏ:
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
C. CuCl2 tác dụng với NaOH sinh đi ra kết tủa blue color lam:
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
D. MgCl2 tính năng với NaOH sinh đi ra kết tủa màu sắc trắng:
MgCl2+ 2NaOH → Mg(OH)2↓ + 2NaCl
Câu 14. Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 theo thứ tự phản xạ với HNO3 quánh, rét. Số phản xạ nằm trong loại phản xạ lão hóa – khử là
A. 5
B. 6
C. 7
D. 8
Lời giải:
